Zellkulturen im Labor anzulegen, ist eine gängige Technik in der Biologie. Seit einigen Jahren gelingt es Forscherinnen und Forschern, solche Zellkulturen deutlich länger wachsen zu lassen als zuvor. So entstehen im Labor kleine dreidimensionale Gebilde, deren Gewebeorganisation der menschlicher Organe ähnelt. Sogar einige Funktionen von Organen können diese Strukturen imitieren. Eben wegen dieser in Teilen bestehenden Ähnlichkeit zu menschlichen Organen nennt man sie Organoide.
Organoide, die hirngewebetypische Gewebestrukturen aus Nerven- und Gliazellen enthalten, werden Hirnorganoide genannt. Von der Forschung mit diesen Hirnorganoiden versprechen sich Forscherinnen und Forscher viele neue Erkenntnisse über die Entwicklung und Funktionsweise des menschlichen Gehirns. Doch haben manche Menschen bei dieser Art der Forschung ethische Bedenken. Dabei stellen sich Fragen wie diese: Wie sehr ähnelt ein Hirnorganoid einem menschlichen Gehirn? Kann ein Hirnorganoid wahrnehmen, was mit ihm geschieht? Gar ein Bewusstsein entwickeln? Oder zumindest Schmerz empfinden?
In diesem digitalen Dossier gibt die Nationale Akademie der Wissenschaften Leopoldina Antworten. Das Dossier führt in die aktuelle Forschung an und mit Hirnorganoiden ein, zeigt Chancen und Möglichkeiten künftiger Forschung auf, und erörtert ethische und rechtliche Gesichtspunkte. Erstellt wurde das Dossier auf Basis der Stellungnahme einer interdisziplinären Arbeitsgruppe von Forscherinnen und Forschern, die den aktuellen Forschungsstand im Sommer 2022 zusammengestellt haben.
Das menschliche Gehirn
Das menschliche Gehirn erfüllt eine Reihe an beeindruckenden Aufgaben. Es erlaubt uns, unsere Umwelt wahrzunehmen und uns in ihr zu bewegen, uns an Vergangenes zu erinnern, uns die Zukunft vorzustellen und zu kommunizieren. Gleichzeitig steuert es die Funktionen unseres Körpers. Es kontrolliert unsere Körpertemperatur sowie die Flüssigkeits- und Nahrungsaufnahme und mobilisiert bei Stress zusätzliche Energiereserven.
Um diese vielfältigen Funktionen zu erfüllen, hat sich unser Gehirn zu einem hoch komplexen Organ entwickelt. Die menschliche Großhirnrinde ist im Vergleich zu anderen Tieren, etwa den Primaten, erheblich vergrößert und deutlich stärker gefaltet. Außerdem enthält sie bestimmte Areale, die so bei keiner anderen Spezies existieren. Man geht davon aus, dass diese vergrößerte Großhirnrinde das menschliche Denken und die Sprache ermöglichen.
Alle Hirnareale bestehen aus ähnlichen Zelltypen. Das Gehirn besteht aus etwa 85 Milliarden Nervenzellen, die in verschiedenen Hirnstrukturen organisiert sind. Jede einzelne Nervenzelle kann über 1000 Verbindungen mit anderen Nervenzellen ausbilden. Somit verfügt das erwachsene Gehirn über fast 100 Billionen Verknüpfungen. Die Informationsverarbeitung erfolgt primär durch Nervenzellen, auch Neurone genannt. Diese sind durch Synapsen miteinander verbunden, die die neuronalen Signale übermitteln.
Viele das Gehirn betreffende Fragen sind aber noch offen:
Wie funktioniert das menschliche Gehirn genau?
Wie entstehen psychische Erkrankungen?
Wie wirken Medikamente im Gehirn?
Wie entwickelt sich das menschliche Gehirn während der Schwangerschaft und nach der Geburt?
Unter welchen Voraussetzungen entstehen neurodegenerative Erkrankungen?
Will man diesen Fragen auf den Grund gehen, steht man allerdings vor einem Problem: Am Gehirn eines lebenden Menschen zu forschen, wäre in vielen Fällen unethisch. Manche Forschungsfragen lassen sich zudem nicht beantworten, ohne in einer kontrollierten Umgebung bestimmte Faktoren isoliert zu untersuchen. Da das menschliche Gehirn einige einzigartige Strukturen enthält, bieten auch Tierversuche nur sehr begrenzte Erkenntnismöglichkeiten.
Hier bieten Hirnorganoide neue Forschungsmöglichkeiten.
Hirnorganoide
Forscherinnen und Forscher können das Wachstum von Hirnorganoiden so beeinflussen, dass sich die Zellen entweder zu einem Hirnorganoid mit mehreren verschiedenen Hirnregionen organisieren oder es bilden sich hirnregionenspezifische Organoide, z.B. Retina-, Mittelhirn- oder Vorderhirn-Organoide.
Hirnorganoide sind ein „zellbiologisches Fenster“, das Einblicke in die menschliche Gehirnentwicklung und in die Entstehung neuronaler Erkrankungen bietet. In ihnen finden sich Zellen, die die Untersuchung von Wechselwirkungen zwischen Zellen und ihrer Umgebung erlauben. So kann beispielsweise die Wirkung von Medikamenten oder der Einfluss verschiedener Giftstoffe, Keime und Viren auf menschliche Gehirnzellen und die Gehirnentwicklung mithilfe von Hirnorganoiden untersucht werden.
Ein konkretes Beispiel für eine praktische Anwendung ist die Analyse der starken Häufung von Mikrozephalien im Zusammenhang mit ZIKA-Virus-Infektionen. An Hirnorganoid-Modellen konnten der kausale Zusammenhang zwischen einer Infektion mit dem ZIKA-Virus und der Entstehung einer Mikrozephalie nachgewiesen, die zugrundeliegenden Mechanismen entschlüsselt sowie mögliche Arzneimittel getestet werden.
Wie entstehen Hirnorganoide?
Wie alle Organoide werden auch Hirnorganoide aus Stammzellen hergestellt. Hirnorganoide bestehen aus Nerven- und Gliazellen, die aus embryonalen Stammzellen (ES-Zellen) bzw. sogenannten induzierten pluripotenten Stammzellen (iPS-Zellen) gewonnen werden.

Durch bestimmte Wachstumsfaktoren können sich entweder hirnregionenspezifische Organoide (z.B. Retina-, Mittelhirn- oder Vorderhirnorganoide) bilden oder es entwickeln sich Hirnorganoide, die aus mehreren dieser Strukturen bestehen.
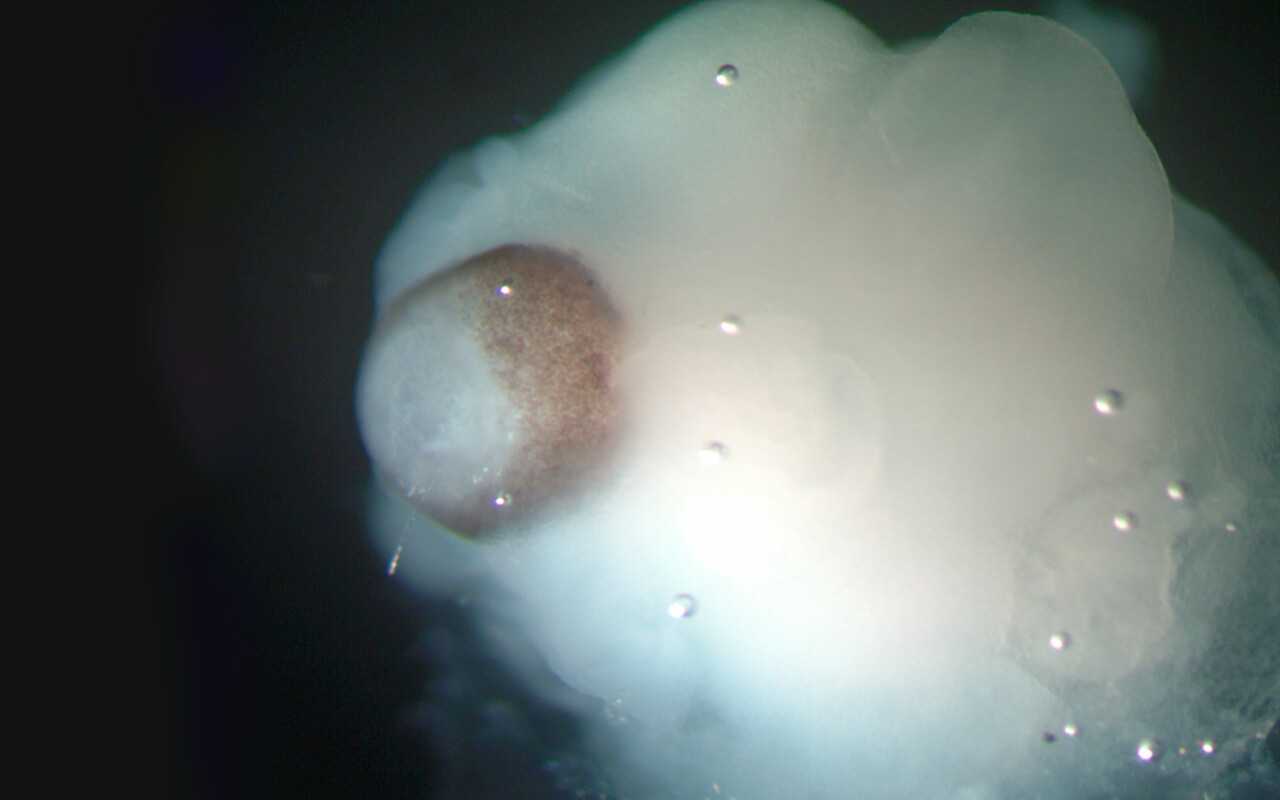
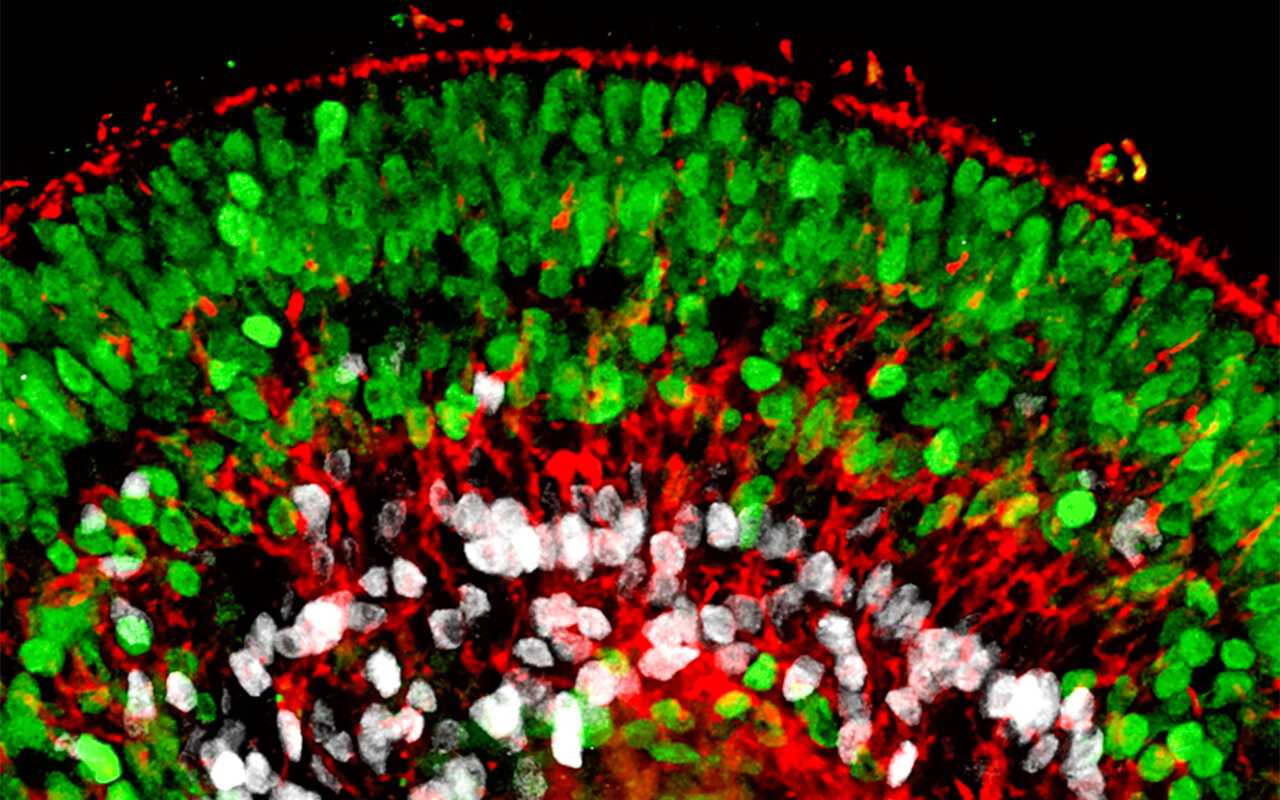
Der Prozess der Hirnorganoidentwicklung ist sehr zeitaufwendig. Die Kultur- und Entwicklungsprozesse entsprechen der Zeitskala der menschlichen Entwicklung. Dies bedeutet, dass sich im Laufe von Wochen und Monaten die Zellen in Organoiden teilen und spezialisieren, und dabei komplexe Strukturen bilden können.
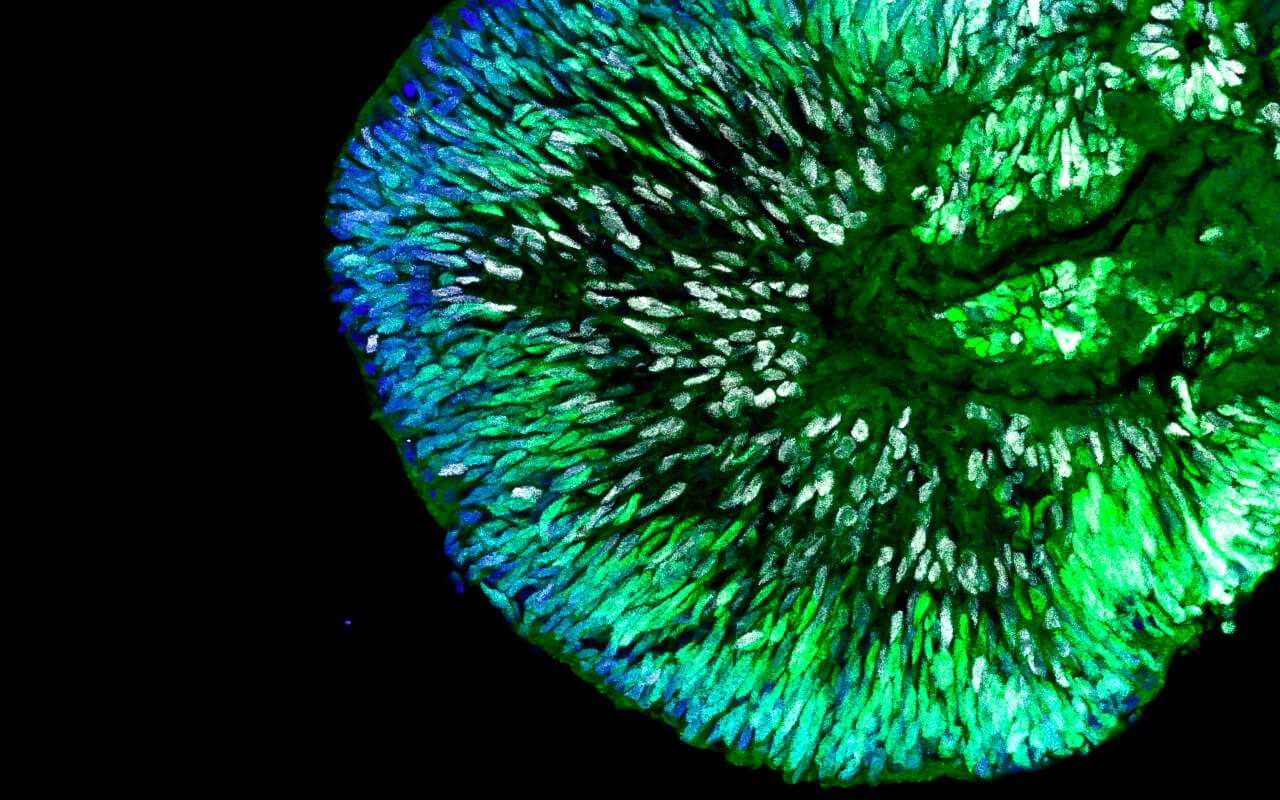
Es lassen sich also zwar frühe Entwicklungsstadien partiell nachbilden, spätere Entwicklungsstadien sind dagegen bislang nicht modellierbar. Das liegt vor allem daran, dass die Hirnorganoide keine Blutgefäße ausbilden. Ohne ein Gefäßsystem und eine stabile Blut- und Nährstoffversorgung sind Größenwachstum und Entwicklungsfähigkeit der Hirnorganoide stark eingeschränkt.

Hirnorganoide, so wie sie heute in der Forschung verwendet werden, sind meistens nicht größer als eine Erbse und können mehrere Wochen bis Monate im Labor kultiviert werden.
Bis heute sind grundlegende Entwicklungsprozesse und Funktionsmechanismen des menschlichen Gehirns nicht verstanden – und damit fehlen wichtige Voraussetzungen, um neurologische, psychiatrische oder neurodegenerative Erkrankungen besser verstehen und behandeln zu können. Obwohl viele Funktionen des menschlichen Gehirns im Tiermodell untersucht werden können, gibt es doch grundlegende Eigenschaften, die einzigartig für die menschliche Gehirnfunktion sind und daher nur in humanen Modellen nachgebildet werden können.
Einige Beispiele für Forschungs-möglich-keiten mit Hirn-organoiden sind die folgenden:

Die Entwicklung des menschlichen Gehirns besser begreifen
An Hirnorganoiden können Prinzipien und Mechanismen der Entwicklung des menschlichen Gehirns studiert werden. An ihnen kann die Entwicklung eines gesunden Gehirns nachvollzogen werden. Sie eignen sich aber auch dazu, die Entstehung von Entwicklungsstörungen zu beobachten und zu verstehen.
Im Moment erreichen Hirnorganoide nur den Reifegrad pränataler, also vorgeburtlicher Gehirne. Frühe Fehlbildungen des Gehirns können im Hirnorganoid-Modell damit gut untersucht werden. Für zahlreiche Störungen und Erkrankungen, die sich erst in späteren Lebensabschnitten entwickeln, wie beispielsweise neurodegenerative Erkrankungen, sind die derzeitigen Modelle aber nicht ausreichend. Das liegt daran, dass die für Hirnorganoide verwendeten induzierten pluripotenten Stammzellen im Prozess der Reprogrammierung Merkmale des biologischen Alters ihrer Ausgangszellen verlieren.

Erkrankungen des Gehirns verstehen
Hirnorganoide helfen bei der Erforschung der Ursachen von Erkrankungen des Gehirns, insbesondere von komplexen neuropsychiatrischen Erkrankungen. Viele dieser Erkrankungen, z. B. Epilepsie oder Autismus-Spektrum Störungen, gehen mit einer gestörten Gehirnentwicklung einher.
Mit Hirnorganoiden, die aus eigenen Stammzellen eines Patienten bzw. einer Patientin hergestellt werden, können Auswirkungen von Mutationen auf die Gehirnentwicklung auf der zellulären, physiologischen und molekularen Ebene beobachtet werden. Damit können Ursachen der Erkrankung und mögliche Therapien, möglicherweise auch für den einzelnen Patienten, untersucht bzw. entwickelt werden.
Bei Erkrankungen, als deren Ursache einzelne Mutationen vermutet werden, ermöglichen es Hirnorganoide in Kombination mit neuen Methoden der Geneditierung, wie z.B. mit der „Genschere“ CRISPR-Cas9, diese Vermutung direkt zu testen. Dabei wird eine Mutation, von der man annimmt, dass sie mit einer Erkrankung in Verbindung steht, in Patientenstammzellen korrigiert oder auch in Stammzellen von gesunden Kontrollen eingebracht. Aus diesen Stammzellen werden dann Hirnorganoide hergestellt und ihre Entwicklung wird verglichen. Diese Untersuchung zeigt, ob die Mutationen tatsächlich ursächlich für die jeweilige Erkrankung sind.
Die meisten Erkrankungen des Gehirns haben allerdings komplexe Ursachen, bei denen Umwelt- und genetische Risikofaktoren zusammenwirken. Bei letzteren sind es insbesondere viele, häufig auch bei gesunden Menschen vorkommenden Genvarianten, die erst im Zusammenspiel zu einem erhöhten Risiko führen.
Hirnorganoide erlauben es, nicht nur lebende, sich entwickelnde Gehirnzellen im Zellverbund zu untersuchen, sondern auch ihre Reaktionen auf mögliche Umweltrisikofaktoren, darunter vorgeburtliche Infektionen, Toxine oder Stresshormone. Oftmals müssen genetisches und Umweltrisiko zusammenkommen, um eine Erkrankung auszulösen. Dies lässt sich in Hirnorganoiden untersuchen und ermöglicht Erkenntnisse, die weder im Tiermodell (wo die genetischen Risiken nicht die des Menschen sind) noch in postmortalem menschlichen Gewebe (das nicht mehr auf die Umwelt reagiert) erzielt werden können.
Medikamente und andere Wirkstoffe testen
Das Gehirn ist während seiner frühen Entwicklung besonders empfindlich, beispielsweise für Toxine, Drogen oder Medikamente. Hirnorganoide ermöglichen es, die Auswirkungen solcher Substanzen auf die Gehirnentwicklung zu untersuchen. Dies könnte die Suche nach frühen Therapien oder präventiven Ansätzen erleichtern. Hirnorganoide werden auch verwendet, um neue Medikamente für bestimmte neuropsychiatrische Erkrankungen zu identifizieren, bisher vor allem für Parkinson, Alzheimer und Autismus.
Hirnorganoide könnten ebenfalls helfen zu verstehen, warum bestimmte Medikamente bei einigen, aber nicht allen Patienten zu einer Besserung führen oder Nebenwirkungen hervorrufen. Dies kann durch vergleichende Untersuchungen von Hirnorganoiden von Patienten, die auf eine bestimmte Therapie ansprechen, und sogenannten therapieresistenten Patienten erreicht werden.
Was können Hirnorganoide (noch) nicht?
Obwohl Hirnorganoide einen wichtigen Baustein in der Erforschung von Erkrankungen des Gehirns darstellen, können sie viele krankheitsrelevante Aspekte nicht, noch nicht oder nicht gut abbilden. Daher sollten sie in Kombination mit anderen Methoden verwendet werden. Ein Beispiel dafür ist die Untersuchung von gestörter Kommunikation zwischen verschiedenen Hirnarealen, die ein zentrales Element vieler psychiatrischer Erkrankungen ist. Hier versprechen sogenannte „Assembloide“ neue Erkenntnisfortschritte, die das Zusammenspiel von verschiedenen Hirnregionen modellieren. Hierfür werden Organoide unterschiedlicher Hirnareale zusammengesetzt.
Hirnorganoide werden auch eingesetzt, um neurodegenerative Erkrankungen wie Alzheimer oder Parkinson besser zu verstehen und neue Therapien zu entwickeln. Allerdings treten manche pathologische Veränderungen erst nach vielen Lebensjahren auf. Hirnorganoide sind bisher allerdings am ehesten mit dem fötalen Gehirn vergleichbar. Methoden, die die Alterung der Organoide beschleunigen oder den Krankheitskontext eines gealterten Gehirns darstellen, könnten hier helfen.
Hirnorganoide als Modell für die Effekte einer Zikavirusinfektion
Das Zikavirus, das in Teilen der Welt endemisch vorkommt und vor allem von Stechmücken der Gattung Aedes übertragen wird, verursacht beim Menschen das sog. Zikafieber.
In den allermeisten Fällen ist der Krankheitsverlauf nach einer Infektion mild oder gar asymptomatisch. Epidemiologische Daten jüngerer Zikavirus-Epidemien ließen jedoch einen ursächlichen Zusammenhang zwischen einer Zikavirus-Infektion in der Schwangerschaft mit einer eingeschränkten Gehirnentwicklung beim Fötus vermuten.
Kinder mit dieser Fehlbildung haben einen auffallend kleinen Kopfumfang, die sogenannte Mikrozephalie.
Setzt man ein in der Entwicklung befindliches Hirnorganoid dem Zikavirus aus, kommt es zu ähnlichen Entwicklungsstörungen.
Die Forschung an Hirnorganoiden hat nicht nur die kausalen Zusammenhänge zwischen der Virusinfektion und einer eingeschränkten Gehirnentwicklung aufgedeckt, sondern auch bei der Identifizierung von Wirkstoffkandidaten für mögliche Therapien geholfen.
Welche ethischen Fragen sollten diskutiert werden?
Manche Menschen haben ethische Bedenken, wenn sie zum Beispiel über Medienberichte von der Forschung mit Hirnorganoiden erfahren. Denn schließlich betrifft diese Forschung diejenigen Zellverbände, die das biologische Substrat unseres Geistes bilden und die auf höchst künstliche Weise instrumentalisiert werden. Häufige Fragen sind zum Beispiel, ob Hirnorganoide zumindest eine rudimentäre Form von Bewusstsein entwickeln oder Schmerzen empfinden könnten.
Einige dieser Fragestellungen sollen hier ethisch eingeordnet werden.
Haben Hirnorganoide ein Bewusstsein?
Die kurze Antwort darauf lautet: Nein. Das liegt an einer Reihe von Gründen. Damit Bewusstsein entstehen kann, müssen nach dem aktuellen Stand der Forschung mehrere Voraussetzungen gegeben sein. So müssen die an der Bildung des Bewusstseins beteiligten biologischen Strukturen unter anderem eine ausreichende Größe, Komplexität und Differenziertheit aufweisen. Die Ausbildung von Bewusstsein erfordert zudem die Kooperation zahlreicher, funktionell spezialisierter Zentren im Gehirn und in ihrer Dynamik präzise abgestimmte Interaktionen von Nervenzellen. Informationen, die durch Verarbeitungsprozesse in unterschiedlichen Hirnregionen bereitgestellt werden, müssen zusammengeführt werden. Nervennetze müssen in einem kritischen, sehr fein regulierten Erregungszustand gehalten werden. Die Verbindungsarchitektur des Gehirns muss bei ihrer Entwicklung durch die von Sinnesorganen vermittelte Interaktion mit der Umwelt so angepasst sein, dass sich höhere kognitive Funktionen ausbilden können. Die Entwicklungsschritte des Organismus und seines Nervensystems sind fein aufeinander abgestimmt und bedingen sich gegenseitig.
Erst durch die Einbettung in den Organismus und die dadurch möglichen Interaktionen mit der Umwelt erwerben Gehirne also die Fähigkeiten, von denen wir annehmen, dass sie auf bewusster Verarbeitung beruhen. Hirnorganoide, so wie sie gegenwärtig hergestellt werden können, haben weder die notwendige Größe und Komplexität noch sind sie mit Sinnesorganen verbunden oder in einen Organismus eingebettet, zu dem sie sich parallel entwickeln. Sie können daher keine noch so rudimentären Bewusstseinszustände haben oder entwickeln.
Die Frage, ob sich dies in Zukunft ändern könnte, wenn tatsächlich eines Tages größere und komplexere Hirnorganoide herstellbar wären, lässt sich nach heutigem Wissensstand weder verneinen noch bejahen.
Spüren Hirnorganoide Schmerzen oder andere Reize?
Das Empfinden von Schmerz ist ein komplexer Vorgang, der Zellen mit Schmerzrezeptoren benötigt und eine Reihe unterschiedlicher Hirnareale voraussetzt und involviert. Schmerzrezeptoren befinden sich an Nervenendigungen in der Peripherie des Körpers (etwa in der Haut), die dann zu Neuronen im Rückenmark ziehen. Selbst wenn solche Nervenzellen mit Schmerzrezeptoren mit Hirnorganoiden gekoppelt werden könnten, bedeutet dies aber nicht, dass Organoide damit auch Schmerzen empfinden können. Denn ihnen fehlen hierfür bislang und in absehbarer Zeit die entsprechenden Voraussetzungen, insbesondere das Vorhandensein und die Verknüpfung unterschiedlicher Hirnareale.
Ähnliches gilt für visuelle Reize: Sehen ist ein komplexer Vorgang, der assoziative Hirnareale voraussetzt, die in der Lage sind, die empfangenen Reize zu interpretieren, daraus Sinn herzustellen. Die Ausbildung bzw. das Vorhandensein bestimmter Rezeptoren ist also nur ein sehr kleiner Teil dieses Prozesses.
Haben Hirnorganoide einen moralischen Status?
In der Bioethik der letzten Jahrzehnte ist der moralische Status zu einem Schlüsselbegriff geworden. Mithilfe des moralischen Status soll entschieden werden, welche moralischen Anrechte einer Entität – z. B. einem Menschen, einem Tier, einem Gegenstand – zustehen. Überwiegend wird der Besitz eines moralischen Status als eine Eigenschaft verstanden, die geborenen Menschen in vollem Umfang, unbelebten Dingen oder Produkten hingegen gar nicht zukommt. Was dazwischen liegt, wird sehr unterschiedlich bewertet.
Oft wird das Verständnis des moralischen Status mit dem Besitz subjektiver Interessen der jeweiligen Entität verbunden. Je komplexer diese Interessen sind, desto gewichtiger wird der moralische Status. Zum Beispiel kann angenommen werden, dass ein schmerzempfindliches Wesen ein Interesse an Schmerzvermeidung hat. Entsprechend sollte es dann ein Anrecht auf Schmerzvermeidung genießen, das nur mit gewichtigeren Gegengründen verletzt werden darf.
Über den moralischen Status von Hirnorganoiden sind eine Reihe von Überlegungen veröffentlicht worden. Diese orientieren sich vor allem an bestehenden Statuszuschreibungen gegenüber Tieren und Menschen in verschiedenen Entwicklungsstadien – z. B. von im Labor erzeugten Embryonen.
Bisherige Überlegungen zu möglichen ethischen Schutzansprüchen für Hirnorganoide orientieren sich vor allem an einer möglicherweise in Zukunft feststellbaren Bewusstseinsfähigkeit. Falls Hirnorganoide jemals in der Lage wären, Schmerzen zu empfinden, wird ihnen mehrheitlich ein Anspruch auf Vermeiden dieser Empfindungen zugestanden.
Ändert sich die Bewertung, wenn Hirnorganoide in einen anderen Organismus transplantiert werden?
Eine wesentliche Grenze für die Ausbildung sehr reifer Zelltypen und komplexer neuronaler Schaltkreise ergibt sich durch die Kultivierungsbedingungen im Labor. Fehlende Blutgefäße beschränken die Nährstoffversorgung insbesondere im Inneren von Hirnorganoiden und begrenzen somit auch ihr Wachstum. Langzeitkultivierte Hirnorganoide verlieren zunehmend ihre dreidimensionale Organisation, also die korrekte topographische Anordnung unterschiedlicher Zelltypen.
Allerdings können menschliche Hirnorganoide in unterschiedliche Wirtsorganismen zu verschiedenen Entwicklungszeitpunkten integriert werden. Diese Integration schafft eine natürlichere Entwicklungsumgebung, welche ein längeres Wachstum und eine bessere Nährstoffversorgung, vor allem durch das vaskuläre System des Wirtsorganismus, unterstützt. Eine Transplantation von menschlichen Hirnorganoiden in einen lebenden Organismus wurde bislang unter anderem an Mäusen, Ratten und Makaken durchgeführt. Bei solchen Versuchen existieren einige natürliche Grenzen. Zum einen ist die Expansion von menschlichen Hirnorganoiden durch den zur Verfügung stehenden Platz begrenzt. Zudem haben zum Beispiel Mäuse eine Lebensspanne von maximal drei Jahren.
Es gibt aber vorstellbare Szenarien, welche eine sehr lange Reifung in Spenderorganismen ermöglichen würden. Ein Szenario wäre eine Transplantation von Hirnorganoiden in das Gehirn eines großen langlebigen Organismus. In einem solchen Organismus, beispielsweise einem Hausschwein oder einem Primaten, könnten sich Hirnorganoide über viele Jahre entwickeln und hätten für die Expansion deutlich mehr Platz zur Verfügung. Es ist anzunehmen, dass Hirnorganoide in solchen Organismen vollständig vaskularisiert würden und es zu intensiven Verschaltungen von Nervenzellen zwischen Wirt und Organoid käme.
Die Verpflanzung eins Hirnorganoids in einen Wirtsorganismus wirft unterschiedliche ethische Probleme auf und könnte unter bestimmten Voraussetzungen den moralischen Status (siehe vorherige Frage) des Wirtsorganismus beeinflussen.
Eine Vaskularisierung in vitro würde diese Probleme vermeiden. Entsprechende Forschungen finden bereits statt. Ein Ansatz ist, mechanische Pumpsysteme mit Assembloiden aus Hirn- und Blutgefäß-Organoiden zu kombinieren. Ein anderer Ansatz besteht darin, Blutgefäße in vitro herzustellen und mit den Hirnorganoiden zu kombinieren. Allerdings ist es auch mit diesem Ansatz bisher noch nicht gelungen, ein geschlossenes, funktionierendes Blutgefäßsystem in ein Hirnorganoid zu integrieren.
Haben Hirnorganoide Rechte?
Das deutsche Recht unterscheidet zwischen Rechtssubjekten und Rechtsobjekten. Der Mensch als Rechtssubjekt kann Träger von Rechten und Pflichten sein. Rechtsobjekte, z.B. Sachen, können dem Menschen von der Rechtsordnung zugeordnet werden, auf sie können sich also Rechte beziehen. Sie haben aber keine eigenen Rechte. Tiere sind zum Beispiel in Deutschland Rechtsobjekte.
Bei neuen Entitäten wie den Hirnorganoiden muss zunächst einmal entschieden werden, ob sie „Rechtssubjekt“ oder „Rechtsobjekt“ sind. Die Zuordnung einer Entität zur Kategorie des „Rechtsobjekts“ hat allerdings nicht zur Folge, dass diese Entität keinerlei rechtlichen Schutz genießt. Das Grundgesetz bezieht beispielsweise Tiere und die Umwelt ausdrücklich in einen verfassungsrechtlichen Schutzauftrag ein, ohne dass ihnen damit zugleich eigene Rechte zugesprochen wären.
Insgesamt gilt daher für Hirnorganoide, dass sie keine Rechtssubjekte, sondern Rechtsobjekte sind.
Fazit
Hirnorganoide bieten neue Möglichkeiten, grundlegende Entwicklungsprozesse und Funktionsmechanismen des menschlichen Gehirns besser zu verstehen. Die Forschung an und mit Hirnorganoiden in vitro wirft auf absehbare Zeit keine regulierungsbedürftigen ethischen und rechtlichen Fragen auf. Auch die Bedingungen, unter denen menschliche Zellen zur Erzeugung von Hirnorganoiden verwendet werden können, sind bereits hinreichend reguliert.
Die aktuellen Grenzen des Entwicklungspotenzials von Hirnorganoiden könnten aufgrund der Dynamik des Forschungsfeldes in Zukunft möglicherweise überwunden werden. Dann gilt es, die etablierten Verfahren der wissenschaftsinternen Selbstregulierung zu nutzen, um auch in diesem Forschungsfeld ethisch, rechtlich oder gesellschaftlich relevante Entwicklungen frühzeitig einschätzen und auf sie reagieren zu können.
Weiterführende Informationen finden sich in der Stellungnahme „Hirnorganoide – Modellsysteme des menschlichen Gehirns“, auf der dieses digitale Dossier aufbaut. Zum Download geht’s hier:

